السلام عليكم ورحمة الله وبركاته نستكمل معكم تلخيص منهج الكيمياء للصف الثاني الثانوي في اليمن وهذا تلخيص للوحدة الثامنة
الجزء الثاني من تلخيص الوحدة السابعة التفاعلات الانعكاسية وسرعة التفاعلات
في هذا الجزء ستقرأ الآتي :
- تعريف المحلول ومكوناتة وانواع المحاليل.
- المركبات الأيونية .
- المركبات التساهمية.
- الإلكتــروليتـــــات.
- الحموض والقواعد , والخواص العامة للحموض والقواعد.
- تعريف أرهينيوس : (1859 – 1927م) .
- تعريف برونستيد – لورى (1923م) .
- تعريف لويس .
- الرابطة التناسقية .
المحلول
تعريفة: هو خليط متجانس يتكون من مادتين أو أكثر بحيث يصعب التمييز بين الدقائق المكونة له ولا يمكن فصل مكوناته بطرق فيزيقية بسيطة ".مكوناتة: يتكون المحلول من مذيب ومذاب.
تعريف المذيب: هي المادة التي توجد بنسبه عالية في المحلول ".
تعريف المذاب: هي المادة التي توجد بنسبه قليلة في المحلول ".
أنـواع المحاليــل :
يوجد تسعة أنواع للمحاليل تنتج عن طريق خلط مذيب ومذاب والجدول التالي يوضح أمثلة لهذه المحاليل بحسب حالة المذيب والمذاب.ملحوظة هامة :
- أغلب التفاعلات الكيميائية تتم في وسط سائل بحيث يكون المذيب سائل
أهم أنواع المذيبات :
الكحول الايثيلي (الإيثانول) والكحول الميثيلي (الميثانول) والإيثير والبنزين والماء.أكثر المذيبات شيوعاً : الماء المقطر.
أنواع المحاليل المائية :
- محاليل الحموض: مثل محلول حمض الكبريتيك ومحلول حمض النيتريك ومحلول حمض الهيدروكلوريك ومحلول حمض الخليك.
- محاليل القلويات: مثل محلول هيدروكسيد الصوديوم ومحلول هيدروكسيد البوتاسيوم.
- محاليل الأملاح: مثل محلول كلوريد الصوديوم ومحلول نترات البوتاسيوم ومحلول كبريتات النحاس.
التوصيل الكهربي للمحاليل المائية :
تنقسم المحاليل المائية من حيث قدرتها على التوصيل الكهربي إلىقسمين هما :
- محاليل لها القدرة على توصيل التيار الكهربائي
- ومحاليل ليس لها القدرة على توصيل التيار الكهربائي
أولاً : (محاليل إلكتروليتية) :
وهي محاليل لها القدرة على توصيل التيار الكهربي ويكون المذاب فيها مادة أيونية أو تساهمية قطبية.المركبات الأيونية :
تعريفها : هي مركبات تتميز بأن الروابط بين ذراتها هي عبارة عن روابط أيونية.عند ذوبان المركبات الأيونية في الماء فإنها تتفكك إلى أيوناتها الموجبة والسالبة.
مــثـــال :
المركبات التساهمية :
تعريفها: هي مركبات تتميز بأن الروابط بين ذراتها هي عبارة عن روابط تساهمية.عند ذوبان المركبات التساهمية في الماء فإنها تتأين جزيئاتها إلى أيونات موجبة وأيونات سالبة وقد يكون هذا التأين تام أو غير تام.
مثال للتأين التام : (يحدث في محاليل الإلكتروليت القوي).
حيث تتأين جميع جزيئات حمض الهيدروكلوريك عند ذوبانها في الماء إلى أيونات الهيدروجين الموجبة (H +) وأيونات الكلور السالبة (Cl -).
مثال للتأين الغير تام: يحدث في محاليل (الالكتروليت الضعيف)
حيث تتأين بعض جزيئات حمض الخليك عند ذوبانها في الماء إلى أيونات الهيدروجين الموجبة H+ وأيونات الاسيتيك السالبة (CH3COO -).
حيث تتأين بعض جزيئات حمض الكربونيك عند ذوبانها في الماء إلى أيونات الهيدروجين H+ وأيونات الكربونات السالبة CO3.
ثانياً : محاليل غير الكتروليتية :
تعريفها : هي محاليل ليس لها القدرة على توصيل التيار الكهربي لأنها لا تتأين جزيئاتها عند ذوبانها في الماء.مـثــــال : ذوبان السكر في الماء لتكوين محلول السكر.
س/ ما الفرق بين عملية التأين وعملية التفكك ؟
الإلكتــروليتـــــات
تعريف الإلكتــروليــــت : هي مادة تتحول إلى أيونات موجبة وأخرى سالبة عند ذوبانها في الماء .أنواع الإلكتروليت :
يوجد نوعان من الإلكتروليتات :
امثلة :
امثلة:
[1] إلكتروليت قوي :
هي مادة تتحول بالكامل إلى أيونات موجبة وأخرى أيونات سالبة عند ذوبانها في الماء.امثلة :
[2] إلكتروليت ضعيف :
هي المادة التي تتحول بعض جزيئاتها إلى أيونات موجبة وأيونات سالبة عند ذوبانها في الماء.امثلة:
حيث يتفكك الماء النقي (المقطر) بشكل ضعيف جداً إلى أيونات الهيدروجين الموجبة وأيونات الهيدروكسيل السالبة أيون الهيدرونيوم (H3O)+ هو عبارة عن جزيء ماء ارتبط به أيون هيدروجين موجب في المحاليل المائية.
كيفية تكوينه :
عند تأين أي حمض في الماء فإن أيونات الهيدروجين الناتجة H+ لا تبقى على حالها في المحلول بل إنها تقوم بجذب جزيئات الماء بقوة مكونة أيونات الهيدرونيوم كما في الصورة التالية :الحمــوض والـقــواعــــد
أولاً : الخواص العامة للحموض والقواعد :
ثانياً : أهم التعريفات التي وضعت للحموض والقواعد :
قام بعض العلماء بإجراء العديد من المحاولات للتوصل إلى تعريف كلاً من الحمض والقاعدة وقد ظهرت ثلاث نظريات تم من خلالها تقديم تعريفات للحض والقاعدة.تعريف أرهينيوس : (1859 – 1927م) :
لاحظ أن محاليل الحموض والقواعد توصل التيار الكهربي.
من المعادلتين الموضحتين في الصورة السابقة لاحظنا أن الحمض تأين في الماء وأعطى أيونات الهيدروجين الموجبة التي اتحدت مع الماء لتكوين أيون الهيدرونيوم.
الـقــاعـــدة : هي مركب كيميائي يعمل على زيادة تركيز أيون الهيدروكسيل (OH+) في المحلول ". لاحظ الصورة التالية:
تعريف برونستيد – لورى (1923م) :
الـحـمـض : " هو المادة التي تميل إلى منح بروتوناً (H+) أو أكثر ".القاعدة : " هي المادة التي تميل إلى اكتساب بروتوناً (H+) أو أكثر ".
ملحوظة هامة :
- أيون الهيدروجين (H+) يطلق عليه بروتون لأنه عبارة عن ذرة هيدروجين فقدت إلكتروناً فتحولت إلى بروتون موجب H+.
مثال [1] : عند ذوبان كلوريد الهيدروجين في الماء فإن :
- غاز كلوريد الهيدروجين يقوم بمنح بروتون لجزيء الماء وبذلك يكون كلوريد الهيدروجين هو حمض برونستدلوري. يسمى الماء بقاعدة برونستد – لورى. حيث أن الماء اكتسب البروتون H+.
- كلوريد الهيدروجين يقوم بمنح بروتون لجزء النشادر وبذلك يكون كلوريد الهيدروجين هو حمض برونستدلورى. تسمى الأمونيا بقاعدة برونستد – لورى حيث أن الأمونيا اكتسبت بروتون H+.
- يقوم جزيء الماء بمنح بروتون لجزيء الأمونيا وبذلك يكون جزيء الماء هو حمض برونستد – لورى. تسمى الأمونيا بقاعدة برونستد – لورى (علل)؟
مما سبق عندما يتحد حمض مع قاعدة ينتج ما يسمى بالحمض القرين والقاعدة القرين
الحمض القرين : هو المادة التي تتكون عند اكتساب القاعدة للبروتون ".
امثلة:
ملحوظة هامة :
س/ حدد الحمض والقاعدة والحمض القرين والقاعدة القرينة في التفاعل الموضح في الصورة الآتية :
- نلاحظ أن الماء قد يكون حمض أو قاعدة
- يكون الماء قاعدة عندما يتفاعل مع حمض أقوى منه ويكون حمضاً عندما يتفاعل مع قاعدة.
المادة الأمفيبروتونية : " هي التي تسلك سلوك الحموض مع القاعدة وسلوك القواعد مع الحمض ".
أمـــثـلـــة للمادة الأمفيبرونية :
- الماء – هيدروكسيد الألومينيوم Al(OH)3- هيدروكسيد الخارصين Zn(OH)2– البكبريتوز HSO3.
س/ حدد الحمض والقاعدة والحمض القرين والقاعدة القرينة في التفاعل الموضح في الصورة الآتية :
تعريف لويس :
أقترح لويس عام 1932 مفهوماً جديداً للحمض والقاعدة لا يعتمد على وجود أيون الهيدروجين أو أيون الهيدروكسيل كما افترض أرهينوس وأيضاً لا يعتمد على اكتساب أو فقد البروتون كما أفترض برونستيد لورى ولكنه اعتمد على زوج الإلكترونات التي تتشكل منه الرابطة التناسقية.الرابطة التناسقية : هي عبارة عن رابطة تنشأ نتيجة منح ذرة لزوج من الإلكترونات تسمى: (الذرة المانحة) إلى ذرة أخرى بها مدار فارغ (تسمى ذرة مستقبلة).
القاعدة : هي المادة التي تستطيع أن تمنح زوج من الإلكترونات لتكوين الرابطة التناسقية.الـحـمـض : هو المادة التي تستقبل زوج الالكترونات الذي يمنحه القاعدة.
مثـــال : عند تفاعل غاز كلوريد الهيدروجين مع غاز الأمونيا ليعطي سحب من كلوريد الأمونيا الصلبة.
ملحوظة هامة :
- تعريف لويس لا يشترط وجود هيدروجين في الحمض أو هيدروكسيد في القاعدة.
- أيون الفضة (Ag+) يمكن أن يكون حمض لويس وأيضاً ذرة النيتروجين في النشادر يمكن أن تكون قاعدة لويس.
- حيث تقوم الأمونيا بمنح زوج من الالكترونات ويستطيع أيون الفضة أن يستقبل زوج الالكترونات الذي تمنحه الأمونيا ليكون رابطة تناسقية لذلك يكون الأمونيا قاعدة لويس بينما أيون الفضة يكون حمض لويس.
مثال[2] :
- ثلاثي فلوريد البورون يمكن أن يكون حمض لويس وأيون الفلور يمكن أن تكون قاعدة لويس.
- حيث يقوم أيون الفلور بمنح زوج من الالكترونات ويستقبله ثلاثي فلوريد البورون ليكون رابطة تناسقية لذلك أيون الفلور يمكن أن يكون قاعدة لويس بينما ثلاثي فلوريد البورون يمكن أن يكون حمض لويس.
نستكمل في جزء اخر الاتزان الايوني تلخيص الوحدة الثامنة كيمياء ثاني ثانوي اليمن ...لا تنسى تسجيل اعجابك بصفحتنا على الفيس بوك والتعليق بكلمة تم لكي تستمر المنشورات بالظهور في اخر اخبارك
كما يمكنك متابعتنا على جوجل بلس وقناة يوتيوب
ممنوع النقل بدون ذكر المصدر











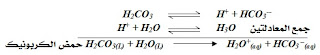









إرسال تعليق