السلام عليكم ورحمة الله وبركاته اليكم ملخص الوحدة السابعة من كتاب كيمياء ثاني ثانوي اليمن وهذا الدرس يتبعة درس اخر لان هذه الوحدة طويله في هذا الدرس
- التصادمات المثمرة وغير المثمرة في ضوء نظرية التصادم.
- أنواع التفاعلات الكيميائية مع ضرب أمثلة لها.
- تعريف طاقة التنشيط.
- مقارنه بين أثر العوامل المختلفة على سرعة التفاعل.
- أهم شروط حدوث الاتزان في التغيرات الكيميائية.
كما يمكنك قراءة ملخص الوحدة السادسة من هنا عناصر المجموعة الرئيسة الثامنة
سرعة التفاعلات الكيميائية و الاتزان الكيميائي
مفهوم التفاعل الكيميائي :
تعريفة : هو عملية كيميائية يتم فيها تحول المواد المتفاعلة إلى مواد جديدة مختلفة في خواصها وصفاتها عن المواد المتفاعلة .
تعريف آخر : هو عبارة عن كسر الروابط بين جزيئات المواد المتفاعلة وتكوين روابط جديدة بين جزيئات المواد الناتجة من التفاعل.
ملحوظة هامة : تستخدم المعادلة الكيميائية الموزونة للتعبير عن هذه التحولات حيث يظهر فيها عدد الجزيئات الداخلة في التفاعل والجزيئات الناتجة عنه.
أنواع التفاعلات الكيميائية :
تنقسم التفاعلات الكيميائية إلى نوعين :- تفاعلات انعكاسية
- تفاعلات غير انعكاسية
أولاً : التفاعلات الانعكاسية :
تعريفه : هو عبارة عن تفاعل يحدث في اتجاهين متضادين .
كيفية حدوثه :
- تتفاعل المواد الداخلة في التفاعل في الاتجاه الطردي مكونة المواد الناتجة.
- تتفاعل المواد الناتجة تلقائياً مع بعضها لتعطي المواد المتفاعله ويسري التفاعل في الاتجاه المعاكس للاتجاه الطردي.
امثلة:
في الاتجاه الطردي : يتفاعل جزيء الماء مع غاز ثاني أكسيد الكربون ليعطي حمض الكربونيك.
في الاتجاه العكسي : ينحل حمض الكربونيك ليعطي جزيء الماء وغاز ثاني أكسيد الكربون مرة أخرى.
في الاتجاه الطردي : يتفاعل جزيء الماء مع غاز ثاني أكسيد الكربون ليعطي حمض الكربونيك.
في الاتجاه العكسي : ينحل حمض الكربونيك ليعطي جزيء الماء وغاز ثاني أكسيد الكربون مرة أخرى.
ملحوظة هامة :
- في التفاعلات الانعكاسية لا يخرج أي من المواد الناتجة من حيز التفاعل في صورة بخار أو راسب.
- في معادلة التفاعل الانعكاسي نلاحظ وجود سهمين متعاكسين أحدهما في الاتجاه الطردي في الاتجاه العكسي
أنواع التفاعلات الانعكاسية :
تصنف التفاعلات الانعكاسية إلى صنفين.[أ] تفاعل متجانس : تكون فيه جميع المواد المتفاعلة والناتجة في حالة واحدة. أما جميعها صلبة أو جميعها سائلة أو جميعها غازية.
مثال
[ب] تفاعل غير متجانس : تكون فيه المواد المتفاعلة والناتجة في حالات مختلفة.
مــثــــــالثانياً : التفاعلات الغير انعكاسية :
" هو التفاعل الذي يحدث في اتجاه واحد فقط لخروج أحد النواتج إما في صورة بخار أو في صورة راسب".تنقسم التفاعلات أللانعكاسية إلى قسمين رئيسيين هما :
[أ] تفاعل متجانس : وفيه تكون جميع المواد المتفاعلة والناتجة في حالة واحدة.
مــثــــال :[ب] تفاعل غير متجانس : وفيه تكون المواد المتفاعلة والناتجة في حالات مختلفة.
مــثــــال :ملحوظة هامة : في التفاعل الغير انعكاسي نلاحظ وجود سهم واحد أي أن التفاعل يسير في الاتجاه الطردي فقط.
س/ قارن بين التفاعلات الانعكاسية والتفاعلات الغير انعكاسية.
ميكانيكية التفاعل الكيميائي :
هي عبارة عن دراسة سرعة التفاعلات الكيميائية والتعرف على الخطوات المتتابعة التي تؤدي إلى تكوين النواتج.فائدة ميكانيكية التفاعل :
- الحصول على معلومات تساعد على التحكم بسرعة حدوث التفاعلات.
- توجيه التفاعل في اتجاه الحصول على النواتج المرغوبة للتفاعلات بالكميات المطلوبة وبطريقة اقتصادية مناسبة وبعيدة عن المخاطر.
- التقليل من آثار التفاعلات الضارة التي تؤدي إلى تلوث الغذاء وفساده وتعفنه.
- التقليل من الأضرار الاقتصادية مثل تأكل المعادن وصدأ الحديد.
حركة الذرات والجزيئات المكونة للمادة :
إن كلمة ميكانيكية تعني "حركة" وبما أن التفاعل الكيميائي يحدث بين الذرات أو الجزيئات أو الأيونات المكونة للمواد المتفاعلة فإننا نستدل على أن هذه الذرات أو الجزيئات تكون في حركة دائمة تمكنها من الاقتراب من الذرات أو الجزيئات الأخرى والتصادم معها وتكوين روابط جديدة تؤدي إلى ظهور النواتج المختلفة في الخواص.
ملحوظة هامة : الذرات أو الجزيئات أو الأيونات المكونة للمادة صغيرة جداً يصعب رؤيتها بالعين المجردة أو بالوسائل المساعدة البسيطة ولكن يمكن إدراك حركتها.
حـركـة الغـازات : تتحرك جزيئات الغاز حركة عشوائية تنتشر في كل اتجاه.
مــثـــال :
- عند فتح زجاجة عطر في مقدمة الصف نلاحظ انتشار العطر في كل الصف واستطاع جميع الطلاب شم رائحة العطر.
حركة السوائل : تتحرك جزيئات السائل حركة انتقالية وحركة اهتزازية.
مــثـــــال :
- عند وضع قطرات من سائل ملون في كأس مملوء بالماء فإنك ستلاحظ أن لون السائل ينتشر في الماء.
حركة المواد الصلبة :
تتحرك جزيئات المواد الصلبة حركة اهتزازية حول موضع سكونها مثل حركة البندول البسيط.مــــثـــــال : تمدد وانكماش المواد الصلبة.
كيفية حدوث التفاعل الكيميائي :
قام الكثير من العلماء بوضع نظريات علمية تفسر ميكانيكية التفاعلات الكيميائية ومن أهم هذه النظريات هي نظرية التصادم.نظرية التصادم :
نـصــهــا : " لا يتم التفاعل الكيميائي بين مكونات المواد المتفاعلة (ذرات – جزيئات – أيونات) إلا بحدوث تصادم تحت شروط محددة ".فروضها :
- يحدث التفاعل الكيميائي نتيجة لتصادم المواد المتفاعلة مع بعضها.
- تعتمد سرعة التفاعل الكيميائي على عدد التصادم بين جزيئات المواد المتفاعلة مع بعضها في الثانية الواحدة وكذلك على عدد التصادمات المثمرة.
التصادم قد يكون مثمراً وغير مثمر :
التصادم المثمر : هو الذي ينتج عنه تكون جزئ جديد.التصادم الغير مثمر: هو الذي لا ينتج عنه تكون أي جزيئات جديدة.
شروط حدوث تصادم مثمر :
- أن يكون وضع الجزيئين مناسباً عند حدوث التصادم.
- أن تتوفر طاقة كافية لحدوث التفاعل تسمح بكسر الروابط بين جزيئات المواد المتفاعلة وتكوين روابط جديدة بين جزيئات المواد الناتجة.ملحوظة هامة :
- إذا لم تتوفر شروط حدوث تصادم مثمر فإن التصادم يكون غير مثمر.
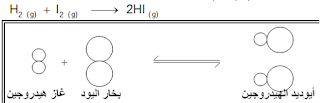
- تفاعل جزيء غاز الهيدروجين (H2) مع جزيء بخار اليود (I2) وينتج عن ذلك جزيئات من غاز يوديد الهيدروجين (2HI) حسب المعادلة الآتية :
ويمكن تفسير حدوث هذا التفاعل وفقاً لنظرية التصادم على النحو الآتي :
- تبعاً للفرضية الأولى، فإن التفاعل بين جزيئي I2,H2، لا يمكن أن يتم إلا بحدوث تصادم بين هذين الجزيئين.
- كلما زاد عدد التصادمات المثمرة في الثانية الواحدة بين جزيئات الغاز، زادت سرعة التفاعل في الاتجاه الطردي لتكوين غاز HI، وكذلك الحال كلما زادت عدد التصادمات المثمرة بين جزيئات HI، زادت سرعة التفاعل في الاتجاه العكسي لتكوين H2 , I2.
- إذا توافرت طاقة كافية لحدوث التفاعل (طاقة التنشيط) بحيث تفوق الحد الأدنى للطاقة اللازمة لحدوث التفاعل، فإنه يمكن أن يتم هذا التفاعل.
- كما أن احتمال حدوث التفاعل يزداد بوجود تصادمات مثمرة تكون فيها الجزيئات في وضعية مناسبة تساعد على كسر الروابط بين جزيئات الغازين، ومن ثم التحام ذرة من الهيدروجين مع ذرة من اليود لتكوين جزيء HI. وكذلك الحال بالنسبة للتفاعل العكسي الذي يتم فيه تصادم بين جزيئي غاز HI لتكوين I2,H2.
طـاقـــة التنشيــط :
" هي أقل طاقة مطلوبة لتحويل جزيئات المواد المتفاعلة إلى ما يسمى بالمركب النشط ".
ملحوظة هامة : كلما زادت الطاقة الحركية كلما كان التصادم مثمر.
مــثــــال :
المركب النشط :
" هو عبارة عن الحاجز الذي ينبغي على جزيئات المواد المتفاعلة تجاوزه للوصول إلى النواتج ".مــثــــال :
- تفاعل الهيدروجين مع اليود لتكوين يوديد الهيدروجين و لكي يتم التفاعل تحتاج المواد المتفاعلة (H2 + I2) إلى طاقة تنشيط حتى يتكون المركب النشط (غير مستقر) ومن ثم تكوين النواتج (2HI).
سرعة التفاعلات:
مــقـــدمـــــة :
بعض التفاعلات تكون سريعة جداً مثل احتراق البارود واشتعاله بشدة مولداً انفجاراً عنيفاً شديد الخطورة وهناك بعض التفاعلات بطيئة جداً تستغرق وقتاً طويلاً لحدوث التفاعل مثل صدأ الحديد. نظراً لأننا لا نستطيع مشاهدة التفاعلات الكيميائية لذلك فإننا لا نستطيع معرفة سرعة التفاعل من خلال المعادلة الكيميائية لذلك يلجأ العلماء لإجراء التجارب لقياس سرعة التفاعل.
هنا يمكن يجيك سؤال علل.
سرعة التفاعل الكيميائي :
"هي نسبة التغير في تركيز المواد المتفاعلة أو المواد الناتجة مع التغير في الزمن".
ملحوظة هامة : يمكن قياس سرعة التفاعل عن طريق تحديد سرعة اختفاء إحدى المواد المتفاعلة أو سرعة ظهور (تكون) إحدى المواد الناتجة.
العوامل المؤثرة على سرعة التفاعل :
- طبيعة المواد الداخلة في التفاعل.
- تركيز المواد المتفاعلة.
- درجة الحرارة.
- وجود العامل الحفاز.
[1] طبيعة المواد الداخلة في التفاعل :
أ- نوع المواد الداخلة في التفاعل : تختلف سرعة التفاعل باختلاف المواد الداخلة في التفاعل.
مثال :- يتفاعل الصوديوم مع الماء بسرعة عند درجة حرارة الغرفة وتنطلق طاقة حرارية بينما يتفاعل الحديد ببطء مع الماء عند درجة 100oم.
ب- مساحة السطح المعرض للتفاعل : تزداد سرعة التفاعل بزيادة مساحة السطح المعرض للتفاعل.
مثال :- تفاعل حمض الهيدروكلوريك المركز مع مسحوق معدن الخارصين يكون أسرع من تفاعله مع كتلة صلبه من معدن الخارصين.
[2] تركيز المواد المتفاعلة :
كلما زاد تركيز المواد المتفاعلة تزداد فرصة التصادمات التي تحدث بين جزيئات المواد المتفاعلة وبالتالي تزداد التصادمات المثمرة (المنتجة) مما يؤدي إلى الحصول على النواتج بسرعة أكبر مما لو كان تركيز المواد منخفضاً. مما سبق تزداد سرعة التفاعل بزيادة تركيز المواد المتفاعلة.س/ علل: تزداد سرعة التفاعل بزيادة تركيز المتفاعلات ؟
ملحوظة هامة : زيادة التركيز لا يؤدي دوماً إلى زيادة سرعة جميع التفاعلات لوجود بعض التفاعلات تشذ عن هذه القاعدة.
مما سبق نتبين أن : سرعة التفاعل تزداد بزيادة درجة حرارة المتفاعلات.س/ علل: تزداد سرعة التفاعل بزيادة درجة الحرارة للمتفاعلات ؟
[3] درجة الحرارة:
عند زيادة درجة الحرارة للمتفاعلات فإننا نحصل على طاقة التنشيط مما يؤدي إلى زيادة الطاقة الحركية للجزيئات المتفاعلة فتزداد احتمال حدوث تصادمات مثمرة مما يؤدي إلى حدوث التفاعل بسرعة أكبر مما لو كان درجة الحرارة منخفضة.مما سبق نتبين أن : سرعة التفاعل تزداد بزيادة درجة حرارة المتفاعلات.س/ علل: تزداد سرعة التفاعل بزيادة درجة الحرارة للمتفاعلات ؟
[4] وجود العامل الحفاز :
تـعـريـفـــه :
- هو عبارة عن مادة تساعد على زيادة سرعة التفاعل الكيميائي غير أنها لا تدخل في تركيب النواتج كما هي عند نهاية التفاعل. أي أن : العامل الحفاز يزيد من سرعة التفاعل الكيميائي.
مـــثــــال :
- تسخين كلورات البوتاسيوم أو تسخين برمنجانات البوتاسيوم في وجود عامل حفاز من ثاني أكسيد المنجنيز كما درست في تحضير الأكسجين.
ملحوظة هامة :العامل الحفاز يبقى كما هو ولا يختفي بعد انتهاء التفاعل.
مـــثــــال :
يصل هذا التفاعل إلى حالة الاتزان التي عندها يكون سرعة تكوين SO3 مساوية لسرعة تفككه (سرعة التفاعل الطردي = سرعة التفاعل العكسي).
حالة الاتزان الكيميائي والمفهوم الديناميكي لها :
لدراسة الاتزان الكيميائي لا بد من الرجوع إلى التفاعلات الانعكاسية التي يمكن أن تعبر عن حالة الاتزان التي يمكن أن يصل إليها التفاعل عند تثبيت العوامل التي قد تؤثر عليه.مـــثــــال :
يصل هذا التفاعل إلى حالة الاتزان التي عندها يكون سرعة تكوين SO3 مساوية لسرعة تفككه (سرعة التفاعل الطردي = سرعة التفاعل العكسي).
حالة الاتزان: هي الحالة التي تكون عندها خواص النظام المتزن ثابتة مع الزمن.
الاتزان في الكون وأثر ذلك على حياتنا :
الله سبحانه وتعالى خلق الكون وسيره وفق نظام متزن ودقيق ومُحكم، فالأرض وما عليها تسير في أنظمة متزنة، إذا اختل جزء منها يؤدي إلى كوارثفي الغلاف الجوي للأرض نجد ثبات مكونات الهواء :
النيتروجين (78%)، الأكسجين (21%)، الغازات النبيلة (1%)، ثاني أكسيد الكربون (0.03%) يعود هذا الثبات النسبي إلى دورة الأكسجين وثاني أكسيد الكربون ودورة النيتروجين ودورة الماء ... إلخ.يظهر الاتزان جلياً في خلق الله جميعاً : ومثال على ذلك الإنسان:
- جميع أجهزة وأنسجة الجسم من صنع الخالق بنظام دقيق. قد يكون أي تغير في نمو الخلايا مرضاً سرطانياً.
- مكونات الدم بنسبها المعروفة في حالة اتزان. وأي خلل في إحداها تعتبر حالة مرضية.
- كمية الماء والأملاح وغيرها من معادن اختلالها في الجسم حالة مرضية.
- السكر في الدم: مثال هام جداً للتفاعل الحيوي المتزن في الجسم، فنسبة السكر العادية تتراوح بين (80 – 120)ملجم/1000سم3 من الدم، والهرمون المسئول عن تنظيم السكر هو (الإنسولين)، الذي تفرزه خلايا بيتا في البنكرياس، الجلوكوز الزائد ولم يحرق يحول إلى جلوكوجين (نشا حيواني) وعند نقص الجلوكوز يتحول النشا إلى جلوكوز وفقاً للمعادلة.
نلتقي في الجزء الثاني من هذا الدرس ... لا تنسى مشاركة هذا مع اصدقائك في المنتديات وفي الفيس بوك
وتقديرا للمجهود يرجى ذكر المصدر عند النقل
دمتم بالف خير













إرسال تعليق