السلام عليكم ورحمة الله وبركاته اليكم ملخص كيمياء ثاني ثانوي الوحدة السادسة (chemistry) منهج اليمن وقد بدأت بها
لأجل ان الطلاب هذه الايام في الفصل الدراسي الثاني ,,, عناصر المجموعة الثامنة في الجدول الدوري ,والتوزيع الالكتروني , مع حل تقويم الوحدة
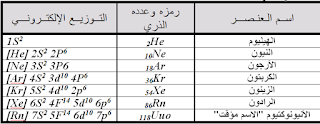
عناصر المجموعة الرئيسة الثامنة:
عناصرها :
[ نيونNe – آرجونAr – كربتونKr – زينونXe – رادونRn – الأنيونو كتيومUnq "الاسم المؤقت" ].موقعها في الجدول الدوري :
تشغل عناصر المجموعة الرئيسية الثامنة العمود رقم (18) في الجدول الدوري.تـكـافـــؤهـــا :
تسمى المجموعة الرئيسية الثامنة بالمجموعة الصفرية لأن تكافؤ عناصرها يساوي صفر لأنها لا تميل إلى فقد أو اكتساب الكترونات بسبب استقرارها.وجـــــودهـــا :
- توجد الغازات الخاملة في الهواء الجوي بنسبة (1%) من حجم الغازات المكونة له حيث يحتل غاز الأرجون (0.92%) بينما (0.08 %) تتوزع على بقية الغازات الخاملة.
- يوجد غاز الهيليوم في كثير من المعادن ذات النشاط الاشعاعي حيث ينتج عن تفتت نواتها جسيمات ألفا التي تتحول إلى غاز الهيليوم عن طريق امتصاص الإلكترونات. مـعــادلــــة :
- يوجد غاز النيون مختلطاً ببعض أنواع المياه العذبة
الخواص العامة لعناصر المجموعة الرئيسية الثامنة (VIIIA)
أولاً : الخواص الفيزيائية :
- جميع الغازات الخاملة عديمة اللون والرائحة.
- أحادية الذرة في درجة حرارة الغرفة.
- يصعب إسالتها [علل]؟ لانخفاض درجاتها الحرجة (درجة الإسالة).
- تذوب في الماء فمثلاً: قابلية ذوبان الأرجون في الماء تفوق قابلية ذوبان الأكسجين.
ثانياً : التوزيع الالكتروني :
تتميز عناصر المجموعة الرئيسية الثامنة بامتلاء مستواها الخارجي حيث ينتهي مستواها الخارجي بـns2p6 ما عدا الهيليوم He.س/ علل : الخمول النسبي لعناصر المجموعة الثامنة ؟
ج/ نظراً لاكتمال مستوى الطاقة الأخير لها.العلاقة بين التوزيع الالكتروني للآيونات والتوزيع الالكتروني للغاز الخامل:
[1] الفـــلـــــزات :
تميل عناصر المجموعة الرئيسية الأولى إلى فقد إلكترون من مستواها الخارجي حتى يصل تركيبها الالكتروني إلى أقرب غاز خامل فتكون أيوناً موجبة أحادية الشحنة.مــثــال (1) :
س/ قارن بين التوزيع الالكتروني لأيون الصوديوم Na+ و التوزيع الالكتروني للنيون.
تميل عناصر المجموعة الرئيسية الثانية إلى فقد إلكترونين من مستواها الخارجي حتى يصل تركيبها الالكتروني إلى أقرب غاز خامل فتكون أيونات موجبة ثنائية الشحنة.
مــثــال (2) :
مــثــال (2) :
س/ قارن بين التوزيع الالكتروني لأيون الماغنسيوم Mg+2 والتوزيع الالكتروني للنيون؟
تميل عناصر المجموعة الرئيسية الثالثة إلى فقد ثلاثة الكترونات من مستواها الخارجي حتى يصل تركيبها الالكتروني إلى أقرب غاز خامل فتكون أيونات موجبة ثلاثية الشحنة.
مــثــال (3) :
س/ قارن بين التوزيع الالكتروني لأيون الألومينيوم والتوزيع الالكتروني للنيون؟
مما سبق نتبين أن التركيب الالكتروني للأيونات الموجبة مماثلاً للتركيب الإلكتروني للغاز الخامل الذي يسبقها في الدورة.
[2] الــلافــلـــــــزات :
تميل عناصر المجموعة السابعة إلى اكتساب إلكترون حتى يصل تركيبها الالكتروني إلى أقرب غاز خامل فتكون أيونات سالبة أحادية الشحنة.
مــثــال :
س/ قارن بين التوزيع الالكتروني لأيون الكلور والتوزيع الالكتروني للآرجون؟
س/ قارن بين التوزيع الالكتروني لأيون الأكسجين والتوزيع الالكتروني للنيون.
مما سبق نتبين أن التركيب الالكتروني للأيونات السالبة يكون مماثلاً لتركيبة الغاز الخامل الموجود في نهاية الدورة.
ثالثاً : طاقة التأين الأولى :
تقل طاقة التأين الأولى بزيادة العدد الذري أي كلما أتجهنا من أعلى المجموعة إلى أسفلها تقل طاقة التأين.س/ ما سبب ارتفاع طاقة التأين الأولى للغازات الخاملة ؟
ج/ لأنه يتطلب كسر مستوى طاقة مكتمل بالالكترونات.رابعاً : الخواص الكيميائية :
يطلق على عناصر المجموعة الثامنة اسم الغازات النبيلة أو الخاملة. نظراً لأنها لا تملك القدرة على التفاعل الكيميائي في الظروف العادية إلا أنه ثبت مؤخراً أن الغازات الخاملة يمكن أن تدخل في التفاعلات تحت ظروف خاصية.[أ] تكوين أيونات :
يمكن للغازات الخاملة أن تكون أيونات تحت تأثير الجهد الكهربي المرتفع داخل أنابيب التفريغ الكهربي مثل أيون الهيليوم He+وعندما يتحد أيون الهيليوم مع الهيدروجين يتكون هيدريد اليهيليوم HeH.
[ب] تكوين هيدرات :
يمكن لبعض الغازات الخاملة أن تكون هيدرات في درجات الحرارة المنخفضة والضغط العالي.مـــثــــــال : هيدرات الرادون السداسية Rn.6H2O
[جـ] تكوين مركبات قفصيه :
تبين مؤخراً أن غاز الارجون يمكن أن يرتبط بجزيئات بلورات بعض المواد العضوية، مثل الكوينول C6H4(OH)2. فعند تبلر الكوينول في وجود غاز الأرجون، وعند ضغط مرتفع يتكون ما يعرف بالمركب القفصي مثل [3C6H4(OH)2.Ar]، حيث توجد ذرة من الأرجون بين ثلاثة جزيئات من الكوينول.استخدامات الغازات الخاملة :
تستخدم الغازات الخاملة لأغراض متعددة في الحياة اليومية، ومن أهم استخداماتها ما يلي :- يستخدم غاز الهيليوم في ملء المناطيد كونه غير قابل للاشتعال، كما يعتبر مصدر لتكوين ما يسمى بالضغط الجوي الاصطناعي، الذي يتم تشكيله في المعامل المقامة في أعماق البحار والمحيطات.
- ستخدم النيون Ne، والأرجون Ar، والكريبتون Kr، والزينون Xe بكثرة وعلى نطاق واسع في التطبيقات الكهربية الضوئية كأنابيب الإضاءة، ولوحات الزينة، واللوحات الإعلانية ذات المظهر الجميل، كما تستخدم الغازات الخاملة في مصابيح الفلاش التابعة لكاميرات التصوير.
- يستخدم الهيليوم والأرجون في عمليات لحام بعض الفلزات مثل الماغنيسيوم والألومنيوم لمنع تأكسدها.
- يستخدم خليط من الهيليوم والأرجون مع النيتروجين في صناعة اللمبات الكهربائية، حيث إنهما يعملان على الحد من تبخر سلك التنجستن المتوهج.
- يستخدم الرادون في الطب لعلاج بعض الأمراض كالسرطان.
إجابات تقويم الوحدة السادسة
س1/ اكتب التوزيع الإلكتروني للبوتاسيوم (K19)، وأيون البوتاسيوم (K+)، ثم قارن التوزيع الإلكتروني لهما مع التوزيع الإلكتروني لذرة الأرجون (Ar18)، موضحاً وجه الشبه بين التوزيع الإلكتروني للأرجون وكلاً من البوتاسيوم وأيونه.
ج1/ التوزيع الإلكتروني هو :
وجه الشبه: نجد أن التوزيع الإلكتروني لأيون البوتاسيوم (K+) مشابه للتوزيع الإلكتروني لغاز الأرجون (Ar).
س2/ أي من التوزيعات الإلكترونية الآتية يمثل عنصراً خاملاً؟:
(1) 2 , 1
(2) 2 , 8 , 1
(3) 2 , 8
(4) 2 , 8 , 8
(4) 2 , 8 , 8
(5) 2 , 7
(6) 2
ج2/ الذي يمثل عنصراً خاملاً هو : (3) ، (4) ، (6).
ج2/ الذي يمثل عنصراً خاملاً هو : (3) ، (4) ، (6).
س3/ اكتب التوزيع الإلكتروني للذرات الآتية : (الهيليوم – النيون – الكربتون)، موضحاً أوجه التشابه في التوزيع الإلكتروني لهذه الذرات.
ج3/ التوزيع الإلكتروني هو :
نلاحظ اكتمال مستوى الطاقة الأخير للغازات الخاملة.
* طاقة التأين : تقل طاقة التأين لذرات العناصر للغازات الخاملة بزيادة العدد الذري.
* درجة الانصهار : تزداد بزيادة العدد الذري.
بينما تكتسب اللافلزات إلكترونات لاكتمال مستواها الخارجي والوصول إلى التركيب الإلكتروني لأقرب غاز خامل.
س4/ لماذا تسمى عناصر المجموعة الرئيسية الثامنة بالغازات الخاملة أو النبيلة؟
ج4/ نظراً لقلة نشاطها الكيميائي بسبب اكتمال مستواها الأخير.س5/ كيف يتدرج كلٍ من: (الحجم – طاقة التأين – درجة الانصهار)، لذرات العناصر الخاملة بزيادة العدد الذري؟
ج5/ * الحجم : يزداد حجم الذرات لعناصر الغازات الخاملة بزيادة العدد الذري.* طاقة التأين : تقل طاقة التأين لذرات العناصر للغازات الخاملة بزيادة العدد الذري.
* درجة الانصهار : تزداد بزيادة العدد الذري.
س6/ كيف يمكن لذرات الفلزات واللافلزات الوصول إلى حالة الاستقرار؟ وما علاقة ذلك بالتركيب الإلكتروني للغازات الخاملة؟
ج6/ تفقد الفلزات إلكترونات من مستواها الخارجي حتى تصل إلى التركيب الإلكتروني لأقرب خاز خامل.بينما تكتسب اللافلزات إلكترونات لاكتمال مستواها الخارجي والوصول إلى التركيب الإلكتروني لأقرب غاز خامل.
س7/ اذكر أهم استخدامات الغازات الخاملة .
ج7/ راجـــع الـــشـــــــرح .
انتهى تلخيص الوحدة السادسة المجموعة الثامنة في الجدول الدوري - ملخص كيمياء ثاني ثانوي اليمن (chemistry)
لا تنسى الاشتراك ليصلك كل جديد او الاعجاب بصفحتنا على الفيس بوك
يرجى ذكر المصدر في حالة النقل


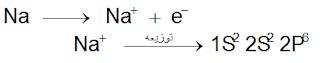


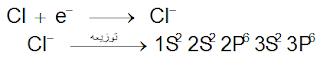




شكرا لكم 💙
ردحذفلا شكر على واجب
حذفاشكركم جميل هو حسن الطيبه ومساعده الطلاب كم كنت اريد مثل هذه التلخيصات ❤
ردحذفشكرا علي هذا العمل الجميل الرائع لتطوير العلم
ردحذف#شكرا-جزيلا
أفضل موقع جزاكم الله خير الجوال
ردحذفصررررراحه تفيدوني كثير
ردحذف